肽合成的价值:多肽是比蛋白质简单、分子量小,由氨基酸通过肽键相连的一类化合物。多肽具有调节机体生理功能和为机体提供营养的双重功效,它几乎影响着人体的一切代谢合成。一种肽含有的氨基酸少于10个称为寡肽,超过的就称为多肽;氨基酸为50多个以上的多肽就是人们熟悉的蛋白质。
到现在,人们已经发现和分离出一百多种存在于人体的肽,对于多肽的研究和利用,出现了空前的繁荣景象。多肽的全合成不仅具有很重要的理论意义,而且具有重要的应用价值。通过多肽全合成可以:
1.验证一个新的多肽的结构;
2.设计新的多肽,用于研究结构域功能的关系;
3.为多肽生物合成反应机制提供重要的信息;
4.建立模型酶以及合成新的多肽药物等。
多肽的合成主要有两种途径:化学合成和生物合成。
化学合成主要通过氨基酸缩合反应来实现。为得到具有特定顺序的合成多肽,当合成原料中含有官能度大于2的氨基酸单体时,应将不需要反应的基团暂时保护起来,然后再进行连接反应,以保证合成的定向进行。
一般要求,这些保护基在合成过程中稳定,无副反应,合成结束后可以完全定量的脱除。
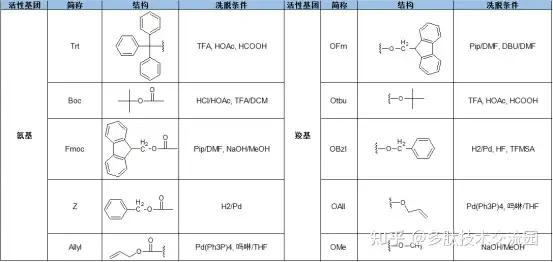
α-氨基保护基
常用的氨基保护基可分为烷氧羰基、酰基和烷基三类。其中烷氧羰基保护基可防止消旋化,因此应用广泛,使用最普遍的是Z、Fmoc和Boc。Z基团可用钯黑,5%~20%钯炭催化氢化法脱除。Boc基团具有与Z基团不同的化学性质,不能用催化氢化法脱除,但易于酸解脱除,它可以和Z基团搭配使用,有选择性地脱除。Fmoc基团的特点是对酸稳定,可被碱脱除。因此尤其适合于合成含有Trp、Met、Cys等对酸不稳定的多肽。
α-羧基保护基
与氨基保护基相比,羧基保护基种类较少,一般以盐或酯的形式存在。盐是对羧基的临时保护,常用的有钾盐、钠盐、三乙胺盐和三丁胺盐等。常用的酯类有甲酯、乙酯、苄酯和叔丁酯。叔丁酯是近年来最常用的羧基保护基,可用酸在温和条件下脱除。
侧链保护基
为了避免副反应的发生,某些氨基酸的侧链官能团需采用适当的保护基加以保护。同一个侧链有多种不同的保护基,可以在不同的条件下选择性的脱除,这点在环肽以及多肽修饰上具有很重要的意义,而且侧链保护基和选择的合成方法有密切的关系。
多肽的化学合成有液相合成和固相合成,其主要的区别在于是否使用固相载体。
1 多肽的液相合成
多肽液相合成主要有逐步合成和片段组合两种策略,逐步合成简洁迅速,被用于各种生物活性多肽片段的合成;片段组合法为合成含有100个以上氨基酸的多肽提供了最有前途的路线,并已成功地合成了多种有生物活性的多肽,其最大的特点是易于纯制。
液相合成方法现在主要采用Boc和Z两种保护方法,现在主要应用在短肽合成,如阿斯巴甜,力肽,催产素等,其相对于固相合成,具有保护基选择多,成本低廉,合成规模容易放大的许多优点。但是与固相合成比较,液相合成主要缺点是,合成范围小,一般都集中在10个氨基酸以内的多肽合成,还有合成中需要对中间体进行提纯,时间长,工作量大。
2 多肽的固相合成
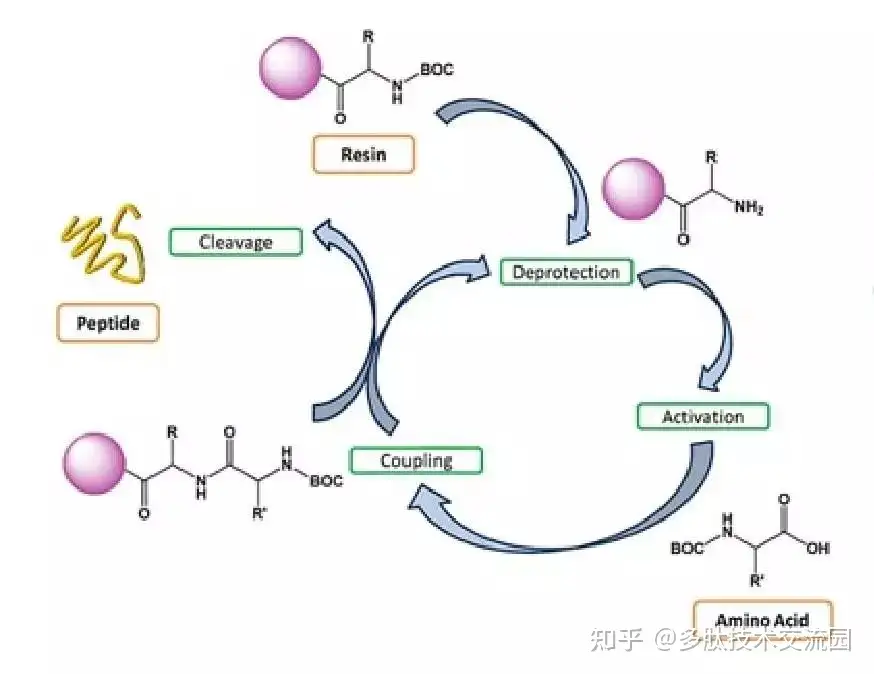
1963年, R.B.Merrifield将氨基酸的C末端固定在不溶树脂上,然后再此树脂上依次缩合氨基酸,延长肽链、合成多肽,从而创立了固相合成法。经过不断的改进和完善,固相法已成为多肽和蛋白质合成中的一个常用技术,表现出经典液相合成法无法比拟的优点。
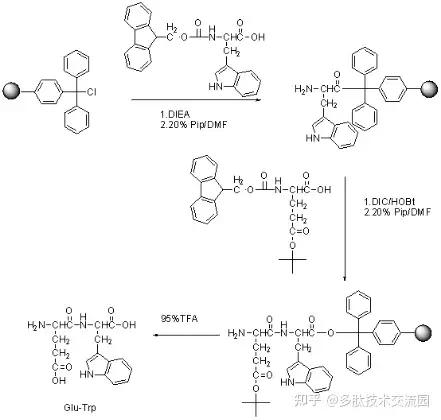
其基本原理是:先将所要合成肽链的羟末端氨基酸的羟基以共价键的结构同一个不溶性的高分子树脂相连,然后以此结合在固相载体上的氨基酸作为氨基组份经过脱去氨基保护基并同过量的活化羧基组分反应,接长肽链。重复(缩合-洗涤-去保护-中和及洗涤-下一轮缩合)操作,达到所要合成的肽链长度,最后将肽链从树脂上裂解下来,经过纯化等处理,即得所要的多肽。每步反应后只需要简单地洗涤树脂,便可达到纯化的目的,克服了经典液相合成法中的每一步都需要纯化的问题。
固相多肽合成现在使用的主要有两种策略:Boc和Fmoc两种。Boc方法合成过程中,需要反复使用TFA脱BOC,而且在最后从树脂上切割下来需要使用HF,由于HF必须使用专门的仪器进行操作,而且切割过程中容易产生副反应,因此现在使用受到实验条件限制,使用也逐渐减少。Fmoc方法反应条件温和,在一般的实验条件下就可以进行合成,因此,也得到了非常广泛的应用。
2.1 树脂的选择
能够用于多肽合成的固相载体必须满足如下要求:
A. 必须包含反应位点(或反应基团),以使肽链在这些位点上,并在之后除去;
B. 必须对合成过程中的物理和化学条件稳定;
C. 载体必须允许在不断增长的肽链和试剂之间快速的、不受阻碍的接触;
D. 另外,载体必须允许提供足够的连接点,以使每单位体积的载体给出有用产量的肽,并且必须尽量减少被载体束缚的肽链之间的相互作用。
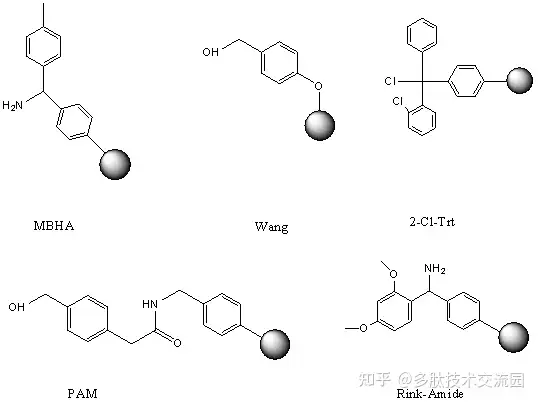
用于固相法合成多肽的高分子载体主要有三类:聚苯乙烯-苯二乙烯交联树脂、聚丙烯酰胺、聚乙烯-乙二醇类树脂及衍生物,这些树脂只有导入反应基团,才能直接连上氨基酸。根据所导入的反应基团的不同,这些树脂可以分为氯甲基树脂、羧基树脂、氨基树脂或酰肼型树脂。Boc合成法通常选择氯甲基树脂,Fmoc合成法通常选择羧基树脂如王氏树脂。
2.2 固相合成切割方法
固相合成完成之后,必须选择合适的切割试剂将多肽从树脂上切割下来,然后经过冰乙醚沉淀,离心收集沉淀,经过HPLC分离纯化,冷冻干燥得到最后产品。由于选择的树脂不同,氨基酸序列不同,在切割时候,选择的切割方法也不完全相同。
一般都是选择酸性条件下切割,对于PAM,MBHA树脂,一般采用HF切割,切割过程中需要添加对甲苯酚,对巯基苯酚,苯甲醚等试剂。而对于Wang,Rink-Amide,Trt树脂,一般采用TFA切割,切割过程中加入,乙二硫醇,苯甲硫醚,水,三异丙基硅烷,苯酚等。
这些添加试剂主要作为碳正离子俘获试剂使用,目的是俘获切割反应过程中生成的碳正离子,减少这些碳正离子对部分氨基酸侧链的进攻导致的副反应,比较容易产生副反应的氨基酸有:Trp,Tyr。切割试剂用量一般10-15ml/g树脂。常用的切割配比:HF/p-cresol/p-thiocresol(90/5/5),TFA/TIS/EDT/H2O(94/1/2.5/2.5),反应一般是在室温条件下2h-4h。
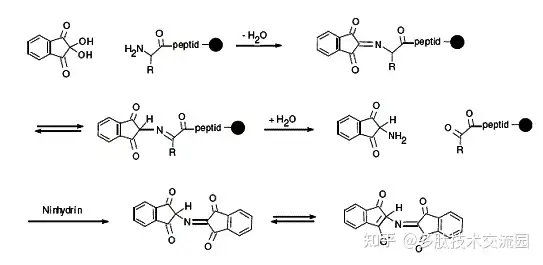
2.3 游离氨基的检测
固相多肽合成中,主要是通过检测树脂上游离的氨基来判断连接的速率,检测方法称为Kaiser方法,判断的标准是,如果还有游离氨基的时候,溶液或树脂会显示蓝色或者红褐色。
Kaiser试剂包括:
A. 6%茚三酮的乙醇溶液
B. 80%苯酚的乙醇溶液
C. 2%0.001M KCN的吡啶溶液
在配制过程中吡啶需要经过茚三酮处理后重蒸再使用。检测时,取少量树脂,加入A,B,C各2-3滴,100℃下加热1-2min,如果溶液或者树脂出现蓝色或紫褐色,表明还有游离的氨基,否则说明完全连接。其他检测游离氨基的方法有:三硝基苯磺酸法,苦味酸法,溴酚蓝法。
发展前景
固相多肽合成已经有几十年的历史了,然而到现在,人们还只能合成一些较短的多肽,更谈不上蛋白质了,同时合成中试剂的毒性,昂贵的费用,反应的副产物等一直都是研究者面临的问题。
而在生物体内,核糖体上合成多肽的速率和产率都是惊人的,那么,能否从生物体合成蛋白质的原理上得到一些启示,应用在固相合成法中,或者是研究出新的合成方法,这也许是多肽合成的发展方向。

