抗体偶联药物 (ADC),强效小分子细胞毒素通过化学键与单克隆抗体结合,比抗体具有更复杂的结构。本文详细描述了应用物理化学方法对抗体偶联药物进行表征研究。对于特定 ADC 最合适的方法,取决于接头、药物和药物的性质,偶联位点的选择(赖氨酸、链间半胱氨酸、Fc聚糖)以及分析技术的改进。例如蛋白质质谱和毛细管电泳技术可以显著提高研究水平,可用于产品表征、常规批次放行和稳定性研究。
简介
抗体偶联药物 (ADC)成为癌症治疗临床研究中一类重要的药物。例如本妥昔单抗(SGN-35)用于治疗CD30 阳性恶性肿瘤(霍奇金淋巴瘤);曲妥珠单抗(T-DM1)应用于人表皮生长因子受体 2 (HER2) 阳性转移性乳腺癌。ADC 作为一类利用单克隆抗体 (mAb) 的靶向选择性来实现细胞毒性的靶向递送。由于这种靶向性,ADC 选择性地消除过度表达靶抗原的肿瘤细胞,同时限制药物对正常健康组织的毒性。ADC 的临床疗效取决于靶点特异性、接头和药物种类、体外和体内稳定性、药物的效力、以及药物种类的分布及小分子偶联数量。因此了解 ADC 的物理化学性质和选择适当的分析技术,以便在制造和存储过程中对其进行评估和质量监控尤为重要。ADC 由三个组件构成:特异于肿瘤抗原的抗体、高效细胞毒素和使细胞毒素能够与单抗共价连接的接头(连接子)。
主要用于蛋白质定向偶联的位点是赖氨酸残基或链间半胱氨酸残基的巯基及抗体偶联位点改造。共轭通常从功能化单克隆抗体通过双功能接头的任一连接,以减少链间二硫键共轭,然后与细胞毒性药物(如作为含硫醇的 DM1),或与预先形成的药物接头(例如vc-MMAE)反应。不同的偶联位点及偶联过程都会导致 ADC 分子在载荷及分布上的异质性,这种异质性从过程控制和分析开发的角度来看都是具有挑战性的。通过优化工艺开发策略及蛋白质工程应用方面的努力,可以减少这种异质性的发生。为此,可以利用丝氨酸选择性地替换链间半胱氨酸。另外,对半胱氨酸偶联位点进行优化,明确药物偶联比,可以降低偶联对单抗的结构及性能造成的影响。
抗体偶联药物如图1所示:
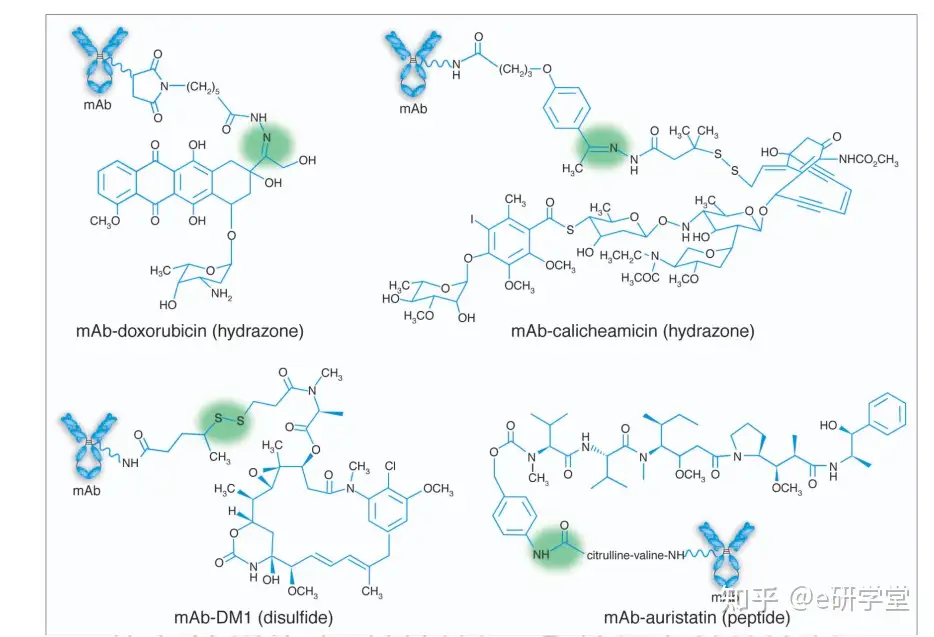
图1:抗体偶联药物化学结构。用于每种药物的接头在括号中标出,阴影部分为可降解基团。图例所示,腙在酸性条件下在靶细胞的溶酶体内释放药物,二硫化物在细胞内还原,肽被溶酶体蛋白酶酶解。
这些药物包括对DNA进行烷基化从而抑制癌细胞的生长,例如加利车霉素;微管蛋白抑制剂,例如美登素。对于任何给定的 ADC,细胞毒素和接头的化学性质,以及连接位点的选择(ADC“架构”),将极大地影响物理化学属性,评估这些属性的分析方法的选择取决于ADC框架结构。不同的ADC可能有不同的分析方法,相同的测定方法(例如,基于电荷的分析或在变性条件下评估 ADC 的结构)可能会提供不同的信息。本文总结了ADC分析表征的方法。在某些情况下,这些方法也可以用于常规放行以及稳定性研究。同时对ADC结构表征也进行了阐述。
抗体药物偶联比(DAR)
ADC 最重要的质量属性之一是偶联药物的平均数量(DAR),因为这决定了可以输送到肿瘤的“有效载荷”,可以直接影响安全性和有效性。多种方法可用于测量此属性,具体取决于药物的特性及其与蛋白质的联系方式(即结合位点和连接子的结构)。
最简单的DAR分析技术是UV/VIS。此方法要求药物和抗体的光谱具有不同的最大吸收波长。ADC 在抗体或者药物最大吸收波长下的吸光度等于抗体消光系数与浓度的乘积加上药物消光系数与浓度的乘积。其中不同波长下的消光系数需根据单组分浓度提前测定。联立两个ADC吸光度方程,根据方程可计算裸抗和药物的浓度,并根据药物与抗体的摩尔浓度比计算DAR。药物在280nm下的吸收值以及抗体在药物最大吸收波长下的吸收值都要算入ADC的吸收值中。正交方法的应用也验证了光谱技术的有效性,包括使用辐射测量方法(共轭用放射性标记药物 ) 和色谱方法,如疏水相互作用色谱 (HIC) 分离。
还原链间二硫键以产生游离巯基,在特定残基处使用含有马来酰亚胺的接头偶联并产生具有每种抗体结合 0、2、4、6 和 8 种药物。由于这种连接化学的异质性显着降低(相对于赖氨酸连接),该混合物可以使用疏水相互作用色谱 (HIC) 进行分析。如图2所示。HIC可以检测不同偶联个数的分布,并通过每个对应峰面积比计算平均DAR值 。HIC 在非变性下进行,在中性 pH 条件下,从高盐到低盐的梯度洗脱,通常在低盐流动相中添加低浓度的有机相可以改善洗脱峰型。即使链接二硫键部分被破坏,链之间共价结合和强非共价力的结合足以在分析过程中保持单位状态完整。因此,图2中每个峰对应完整抗体偶联药物的个数。
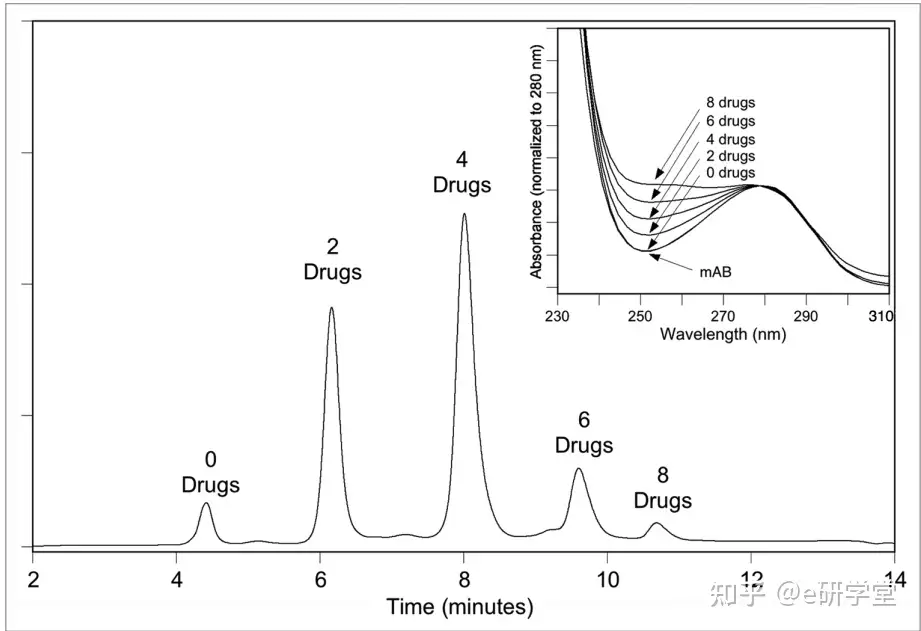
图 2. TOSOH Biosciences Butyl-NPR 色谱柱上对 mAb-vc-MMAE 进行疏水相互作用色谱 (HIC) 分析产生五个主要峰,对应于含有0、2、4、6和8个药物的抗体。另外归一化 280 nm 处吸光度,显示 248 nm 处吸光度随着偶联药物水平的增加而增加。
药物分布
除了关于平均 DAR 的信息外,还有多个方法已被用于分析药物相关形式的分布(例如,含有0、1、2,…,n 个药物的占比)。这是一个重要的 ADC 特性。因为不同的形式可能有不同的药代动力学和毒理学特性。由于它们的高度异质性,通过色谱分析并不是那么容易。许多研究使用质谱来研究他们的药物分布。质谱分析:1990 年代初期,ADC 质谱表征首次描述了 UV MALDI-TOF 仪器的使用。虽然 MALDI-TOF 方法对于大分子的相对质量精度较差,其有限的分辨率无法提供不同药物的负载,观察到的峰值质量偏移计算平均载药量,峰形用于对其分布进行数学建模。对于赖氨酸偶联药物,观察到未偶联抗体及其相应的 ADC 轻链和重链质谱迁移,表明两条链都被修饰。使用活化的紫杉醇制备的赖氨酸连接的偶联物使用 UV MALDI-TOF MS 进行分析,这种方法也用于确定平均 DAR。使用飞行时间耦合电喷雾电离的 LC-MS(TOF) 或三重四极杆质量检测器,可以提供更高的质量精度和分辨率。将 SEC 色谱与 ESI-MS 相结合,从样品中去除缓冲液成分并提高光谱性能。图3为使用该方法获得的去糖基化 huC242-DM4 的去卷积质谱示例。因为赖氨酸连接的偶联物含有完整的二硫键,在高酸性和高有机溶剂相存在下抗体链不会解离,用链间半胱氨酸连接的偶联物会观察到电离效应。可以获得完整 ADC 的每种药物形式的准确质量。解卷积质谱的积分可以用于估计 DAR;然而,这假设基于所有物质的等效回收和电离,然而,由于电荷变化及与带正电荷的胺的结合导致的疏水作用。情况往往会更加复杂。与带正电荷的胺的结合有关物质的电荷和疏水性都会影响 MS 的准确性。因此,必须通过实验验证等效电离和回收率的假设。与紫外光谱和 ESI-TOF-MS 比较表明, MS 方法经过优化会得到较好的数据。
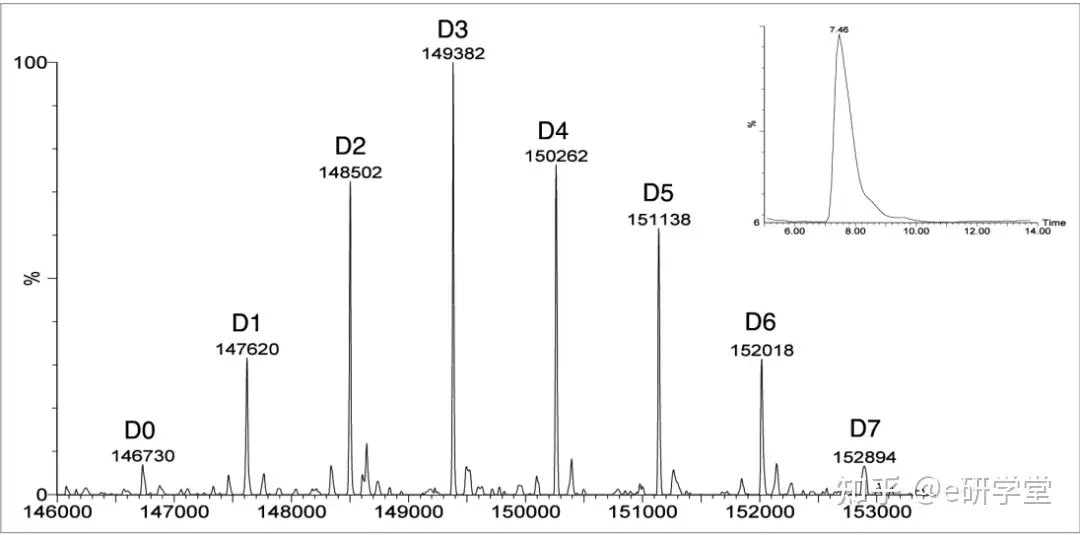
图3:去糖基化 huC242-DM4 的 SEC/ESI-MS 去卷积质谱。每个峰上的标签是指结合药物的数量。右上图为蛋白质的 SEC 洗脱。
对于赖氨酸偶联,非还原条件下,MS显示完整偶联物的解卷积谱图,显示了预期质量的分布。还原条件下,两条链被HPLC分离,重链和轻链的偶联个数可以从MS获取。轻链偶联个数0,1。重链偶联个数0,1,2,3。不同于赖氨酸偶联,半胱氨酸药物通过LC-MS不能直接体现药物偶联分布情况,因为药物会在电离的酸性环境下游离出来。尽管如此,LC-MS依旧可用于还原的共轭物确认峰分配。
色谱分析药物分布
对于抗体偶联药物,可以使用疏水作用色谱(HIC)来测定半胱氨酸连接或者特定位点偶联物中药物抗体偶联比。通过HIC分离单峰可以进行其他研究,例如SEC-HPLC、ELISE、细胞活性等。图2显示通过HIC分离单克隆抗体-vc-MMAE偶联物,每一个峰对应不同的偶联个数。对于赖氨酸偶联,如果药物本身不带电荷,偶联会减少抗体的净电荷。基于电荷的分离,例如离子交换色谱法 (IEC)、等电聚焦凝胶电泳 (IEF) 或毛细管等电聚焦 (cIEF)可以估计这些 ADC 的药物分布。IEC和IEF表明这些偶联物实际为混合物,含有50%的裸抗未偶联。改变偶联条件可以降低裸抗的含量,如果偶联的药物带有电荷则会影响偶联物的PI。
反相高效液相色谱法由于低pH和高有机溶剂的变性作用,可用于分离和定量不同药物载量的轻、重链。RP-HPLC分离对于特定位点(链间半胱氨酸)偶联的形式有效;然而使用RP-HPLC分析赖氨酸连接偶联物还没有成功的报道。
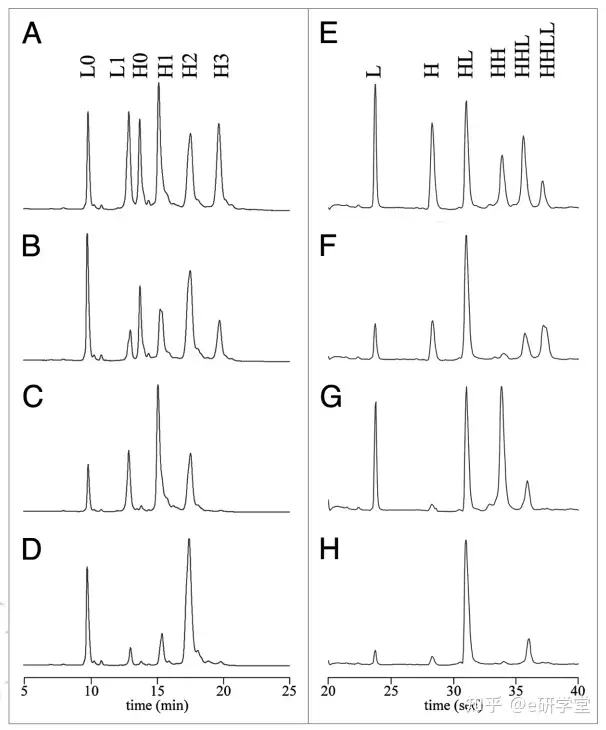
图4(A-D)反相高效液相色谱分析使用不同还原/再氧化方案生成的DTT还原偶联物。(E-H)对应于(a - d在非还原性条件下CE-SDS分析的样品。
对于半胱氨酸连接的偶联物,可以通过色谱(RP-HPLC)测定每个偶联重链和轻链药物的加权峰面积百分比来计算平均DAR。用该方法得到的DAR与基于药物和抗体紫外吸收的分光光度法有良好的相关性。RP-HPLC还用于表征与工程单克隆抗体相关的位置异构体,其中形成链间二硫键的半胱氨酸被丝氨酸残基取代通过反相高效液相色谱(RP-HPLC)测定了与两种、四种和六种药物/mAb的同分异构体分布。
分子排阻色谱分析偶联药物
与任何蛋白治疗一样,ADC中存在的高分子(即聚集物)有可能引发抗治疗性抗体(ATA)反应。ATA反应的潜在临床结果可能是以下任何组合:输液相关反应,产品药代动力学的改变(即更快的清除)和减少药物暴露。许多与抗体结合产生ADC的药物是相对疏水的,会增加生产过程或者储存过程中聚集形成的可能性。因此,在放行检测测试和稳定性检测中,都需要精确和有效的方法来测量聚合和碎片的程度。通常使用与本身单克隆抗体相同的尺寸排除层析分析。例如,Willner等人报道的含有DOX的偶联物在TSK 3000SW上进行了分析,用磷酸缓冲盐水洗脱。然而该方法应用于ADC时,显示出较差的峰形和单体与聚合(例如二聚体)的不完全分离。在Doronina等人的研究中,结合BR96起始单抗的SEC比较显示ADC的保留时间和峰尾略有增加。这表明,附着的疏水药物导致ADC与柱固定相之间的非特异性相互作用。在流动相中加入有机改性剂,如25%丙二醇,10% DMSO或15%乙腈,可以克服色谱性能中的非特异性影响,并且对恢复峰形和分辨率也有很好的效果(图5所示)。除了消除与共轭物洗脱有关的峰拖尾和单体与二聚体分离度差的问题,溶剂的加入使得T-DM1单体和未偶联的单克隆抗体的保留时间相同(图5B所示)。
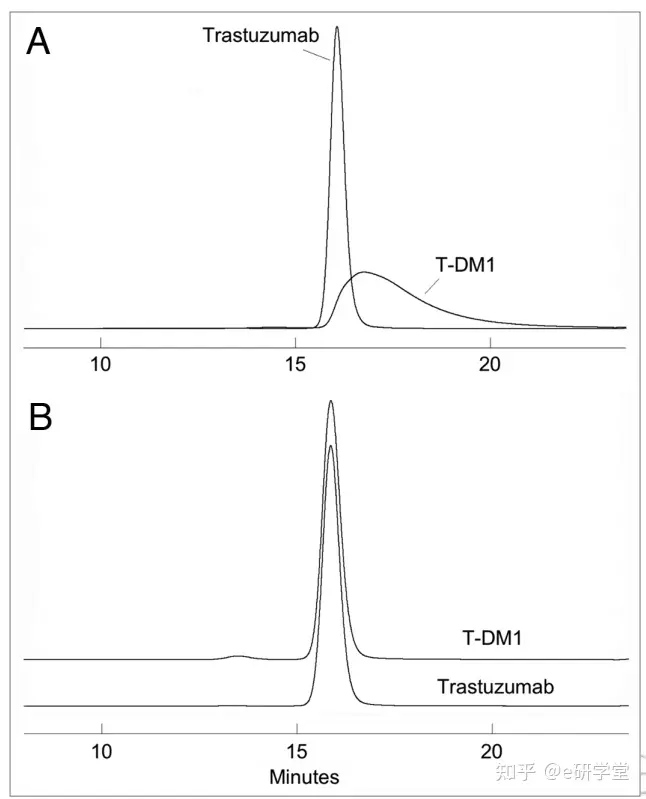
图5:TSK 3000SWXL色谱柱以0.5 mL/min流速进行SEC分析,吸光度为280nm。(MPA)移动0.2 M KPi和0.25 M KCl, pH 6.95。(B) 85% KPi/KCl流动阶段;15%异丙醇。
SEC是在非变性条件下进行的,并且如上所述的HIC分析,不会导致链间二硫化物修饰形成的非共价抗体链的解离。SEC分析可以用于通过抗体铰链处的裂解来量化片段的形成,这是一种典型的非酶解反应,经常在液体制剂存储的单抗中观察到。在变性条件下对还原性和非还原性ADC偶联物进行结构表征,而这在完整蛋白水平上无法轻易评估。对于在非变性条件下(例如SEC和HIC分析)抗体和链的高亲和力导致ADC作为一个完整的分子洗脱。传统上,SDS-PAGE用于蛋白质的分子量分离。一些报道已经描述了通过SDS-PAGE还原ADC来解析非偶联形式的药物链。CE-SDS已经成为首选技术,在速度、重现性、分辨率和易于自动化方面明显优于SDS-PAGE。如图4E-H所示,CE-SDS技术对cAC10-vc-MMAE结合物的分析。
电荷异构体分离
由脱酰胺作用或N端焦谷氨酸形成的电荷变异是单抗的一个重要质量属性,特别是当这些变化影响结合或生物活性时。根据药物的特性,连接子和结合位点(即赖氨酸、链间巯基、碳水化合物),适用于裸抗的方法可能不适用于ADC,或可能给出显著不同的信息。未带电的连接体和药物通过赖氨酸残基连接,使每个结合的药物连接体的净正电荷减少。在这种情况下,基于电荷的分离,如使用离子交换色谱(IEC)或等电聚焦(IEF),得到的是药物负载的特征,而不是关于单抗的信息。对于吉妥珠单抗ozogamicin, IEC显示大部分卡奇霉素大约在一半的抗体上,而45-65%的产品是低偶联部分,基本上是未偶联的抗体。用IEF凝胶电泳也可以定性地观察到类似的分布。毛细管成像等电聚焦(iCIEF),已经成功地应用于分析单抗的带电变异体。这种方法对ADC分析的适用性取决于药物连接物的性质(特别是电荷)、连接方式(赖氨酸、半胱氨酸、碳水化合物)以及由此产生的产物的复杂性。
游离小分子分析
另外,所有ADC共有的一个重要质量属性是游离(未结合)药物的数量,这会引起对毒性和潜在安全问题的关注。未偶联药物或药物相关杂质的残留量可能残留在最终产品中,这是偶联反应下游纯化步骤不完全去除的结果。未偶联药物的相关形式,如连接药物种类或其他降解产物,也可以在偶联物存储期间释放。因此,开发和应用合适的方法来检测、表征和量化游离药物种类是至关重要的。
采用酶联免疫吸附试验(ELISA)、毛细管电泳(CE)、高效液相色谱(HPLC)方法测定不同adc中游离药物水平。用竞争酶联免疫吸附法测定cAC10-vc-MMAE28与组织蛋白酶B孵育后释放的游离MMAE。将组织蛋白酶b处理的样品和游离MMAE定量标准品与固定浓度的MMAE-偶联辣根过氧化物酶报告基因(HRP)混合,随后加入涂有抗MMAE单克隆抗体的微量滴定板。样品中的游离药物与报告基因与平板的结合相竞争,然后显色检测的。利用CE(激光诱导荧光IF)对DOX偶联BR96单抗中游离DOX和DOX腙(DOX- hdz)进行了高灵敏度和选择性的检测和鉴定。之所以使用LIF检测,是因为DOX在激发波长490 nm发射波长550 nm处表现出很强的荧光信号。完整的ADC和小分子有较好的分离。HPLC法对游离药物具有良好的精密度、灵敏度和专属性。由于细胞毒性药物多为低分子量疏水分子,反相高效液相色谱法已成为目前应用最广泛的分离和定量分析技术。将含有蛋白质的ADC样品直接注射到反相高效液相色谱柱上有一个潜在的问题:由于蛋白质与固定相的不可逆结合,导致色谱柱退化。在高效液相色谱柱内,蛋白质的积累会堵塞固定相的孔隙,从而降低柱的性能,从而抑制分析物向多孔填料的扩散传质,降低柱的容量和效率。如果在一个色谱柱内发生大量的蛋白质积累,就会产生色谱柱背压,从而影响色谱柱的性能。可以安装保护柱,并定期更换,以防止污染和损坏分析柱。除了使用保护柱外,为了保持反相高效液相色谱柱的性能,还可以使用其他技术。这些技术包括在色谱分析之前将样品中的游离药物从蛋白质-药物结合物中分离出来。虽然这种方法有点繁琐,使用有机溶剂沉淀ADC蛋白是一种用于分析游离药物种类的前处理方法,游离药物种类可溶于有机提取物中。将含有阿霉素(ADM)的偶联物与等量的乙腈混合,除去沉淀的偶联物后,用反相高效液相色谱分析有机提取物中是否存在未偶联的ADM或ADM衍生物。另外还可以使用离线固相萃取(SPE),其中被分析物被保留在固定相上。例如,通过Porapak Q(一种多孔聚合物离子交换基质)的吸附色谱,从蛋白质组分中去除微量的游离道诺霉素和阿霉素。这种物质能有效地结合游离的道诺霉素和阿霉素,同时蛋白质药物不被保留地通过色谱柱。然后用丙酮或甲醇将游离药物洗脱柱上以作进一步分析。RP-HPLC结合质谱(MS)分析,可以鉴定和定量分析从偶联物中释放的各种细胞毒性物种。同样,RP-HPLC/MS可用于检测偶联物的体外稳定性,并监测血浆或培养的肿瘤细胞系中释放的游离药物种类。用LC/MS/MS分析cAC10-vcMMAE在人、小鼠和狗血浆中的释放量。在人和狗血浆中,10天后释放量小于总药物(MMAE)的2%。在小鼠血浆中,这段时间释放的药物不到总药物的5%。随后对同一样品进行的全扫描LC/MS定性分析(包括紫外检测)没有发现可识别为药物或药物连接体降解产物的其他分子种类。同样的技术可以应用于ADC的制造和存储样品,以表征最初可能存在或随着时间的推移形成的药物相关杂质。
肽图分析
肽图谱是检测和表征蛋白质修饰的有力工具,如氨基酸取代、焦谷氨酸形成、氧化、脱酰胺化、异构化、糖基化、二硫置换、肽键断裂和交联。ADC的酶切可以用来鉴定含药肽。例如,在反相-高效液相色谱图中,偶联疏水药物的多肽的洗脱时间可能比未修饰的出峰晚,因为柱的滞留时间会增加。蛋白酶活性也可能受到结合作用的影响;例如,胰蛋白酶不会在药物修饰的赖氨酸上裂解,从而产生更大、更多的疏水肽。ADC酶解物的独特色谱或电泳图谱可用于建立产品鉴别,表征药物结合的特定位点,并在复杂的ADC产品中建立工艺一致性。ADC多肽的色谱分离结合质谱分析可以提供有关偶联位点位置的重要结构信息。
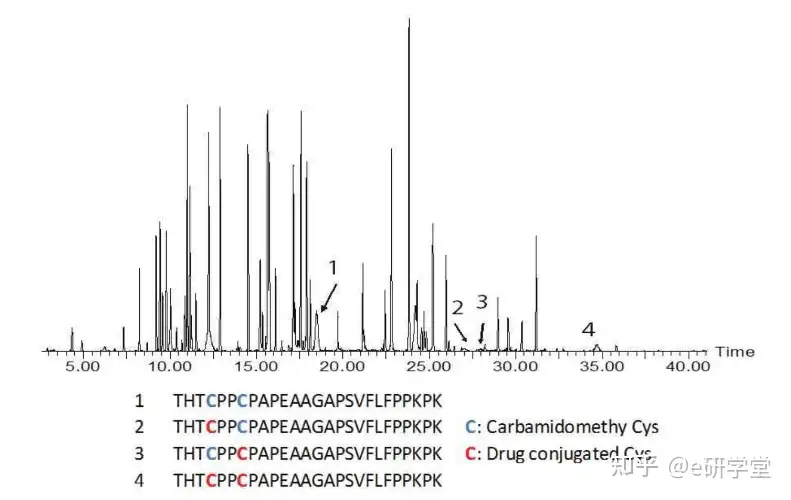
图6 半胱氨酸偶联药物经Trypsin酶切处理后的uplc-ms肽图。图中标示出重链T21肽段的色谱峰和序列信息。T21肽段有2个偶联位点,峰1为未偶联毒物的T21肽段,峰2峰3为偶联1个毒物的T21肽段,峰4为偶联1个毒物的T21肽段
由于抗体表面有许多可接近的残基,这些残基可能会发生反应,通过赖氨酸氨基侧链偶联通常会产生复杂的偶联物混合物,这些偶联物在药物附着的数量和药物连接的位置上都不同。由于偶联物的异质性、抗体的大分子尺寸和单修饰残基的低丰度,使结构表征具有挑战性。
生物分析
许多与抗体偶联的细胞毒性药物具有很强的疏水性(如紫杉醇、DM1、calicheamicin、DOX)。尽管药物和蛋白质的大小差异很大,但这些药物与抗体的共价结合对ADC的稳定性、溶解度和溶液相互作用有显著影响。
对高级结构和稳定性的影响
相对于未偶联药物的裸抗,ADC的生物物理特性可能会因为结合药物的存在而变得复杂。许多用于ADC的细胞毒性药物表现出很强的近紫外吸收,这可能会干扰用于蛋白质三级结构表征的近紫外- CD和荧光光谱方法。ADC在近紫外光谱中的光谱信号可能依赖于DAR,这导致了区分观察到的近紫外光谱变化是来自三级结构的变化还是来自DAR的变化的挑战。另一方面,Far-UV-CD可以用来检测药物偶联对单抗二级结构的影响(前提是结合的药物没有干扰),热分析方法如差示扫描量热法可用于研究药物偶联对抗体构象稳定性的影响。对T-DM1的研究表明,由于赖氨酸残基的修饰和偶联,Fc结构域的构象稳定性受到影响。因此,抗体构象和稳定性在剂型开发过程中应仔细研究。
对溶解度的影响抗体的溶解度在与疏水药物偶联后可显著改变。溶解度降低可能是由于药物通过表面暴露的赖氨酸偶联时表面净电荷的减少,也可能是由于偶联药物和连接剂的疏水性。随着共轭度的增加,对溶解度的影响也增加。DAR高的ADC在偶联过程中有沉淀或聚集趋势。由于高盐浓度会导致疏水相互作用的增加,与未偶联抗体相比,ADC的溶解度可能对高盐的影响更敏感。含有ADC的溶液的存储(例如,离子交换过程色谱流出液)可能会导致具有高DAR的ADC聚集增加或选择性沉淀,导致蛋白质颗粒的形成。
总结
在过去的十年中,ADC作为一种抗癌治疗极具潜力的药物,引起了人们越来越多的兴趣。与未偶联的裸抗相比,ADC由于偶联的异质性而具有更高的复杂性。分析技术的改进提供了更好的工具去表征这些产品,从而为ADC开发人员提供工艺和配方开发所需的信息,并确定QC批放行和稳定性测试所需的方法。
生物分子质谱的发展,包括更好的TOF分析仪,使药物分布和偶联位点的鉴定更加准确。新一代的CE仪器和方法(包括基于硅芯片的BioanalyzerTM和成像毛细管等电聚焦系统)提高了该技术的定量能力,使其适用于详细的表征和常规使用。高效液相色谱柱技术的改进允许从蛋白酶消化的单抗和由它们制造的ADC中获得的复杂多肽混合物的高分辨率分离。分析技术的改进,加上适当的生物分析方法,如ELISA和基于细胞的效价测定,使人们更好地了解ADC结构是如何影响疗效和安全性等临床结果。这样就可以更正确的决定哪些ADC候选物可以进入临床,临床样品生产开始后,应采用哪些方法进行常规GMP检测和稳定性监测。影响生物技术产品安全性和有效性的物理化学特性是其关键质量属性(cqa)。对于作为治疗药物的单克隆抗体,有明确的属性是关键的。对于ADC,很明显会有一组不同的cqa,其中一些可能与mAb中间体的cqa重叠。如上所述,adc的一些潜在cqa是大小变异(聚集和片段)、药物分布和平均DAR、游离药物水平。其他的cqa可能会在此基础上确定,并可能包括相关的变异体。对于抗体,其他工艺杂质,如与药物和偶联物相关的杂质,以及产物的异构体。这些cqa(其中一些可能出现在控制系统上,另一些仅用于表征)可以在ADC开发期间用于证明该工艺可以重复地满足制定的产品标准。还可以使用基于统计的实验设计技术对工艺进行表征,以了解工艺条件如何影响这些关键属性,然后可以对关键工艺参数建立适当的标准。通过分析和工艺的结合,可以生产出具有一致质量、安全性和有效性的ADC用于临床和商业用途。
参考文献
1. Senter PD. Potent antibody drug conjugates for cancer therapy. Curr Opin Chem Biol 2009; 13:235-44.
2. Ranson M, Sliwkowski MX. Perspectives on anti-HER monoclonal antibodies. Oncology 2002; 63:17-24.
3. Morris PG, Fornier MN. Novel anti-tubulin cytotoxic agents for breast cancer. Expert Rev Anticancer Ther 2009; 9:175-85.
4. DiJoseph JF, Dougher MM, Armellino DC, Evans DY, Damle NK. Therapeutic potential of CD22-specific antibody-targeted chemotherapy using inotuzumab ozogamicin (CMC-544) for the treatment of acute lymphoblastic leukemia. Leukemia 2007; 21:2240-5.
5. Younes A, Bartlett NL, Leonard JP, Kennedy DA, Lynch CM, Sievers EL, et al.Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas. N Engl J Med 2010; 363:1812-21.
6. Laguzza BC, Nichols CL, Briggs SL, Cullinan GJ,Johnson DA, Starling JJ, et al. New antitumor monoclonal antibody-vinca conjugates LY203725 and related compounds: design, preparation and representative in vivo activity. J Med Chem 1989; 32:548-55.
7. Chari RV, Martell BA, Gross JL, Cook SB, Shah SA, Blattler WA, et al. Immunoconjugates containing novel maytansinoids: promising anticancer drugs. Cancer Res 1992; 52:127-31.
8. Hudecz F, Garnett MC, Khan T, Baldwin RW. The influence of synthetic conditions on the stability of methotrexate-monoclonal antibody conjugates determined by reversed phase high performance liquid chromatography. Biomed Chromatogr 1992; 6:128-32.
9. Chari RV, Jackel KA, Bourret LA, Derr SM, Tadayoni BM, Mattocks KM, et al. Enhancement of the selectivity and antitumor efficacy of a CC-1065 analogue through immunoconjugate formation. Cancer Res 1995; 55:4079-84.
10. Greenfield RS, Kaneko T, Daues A, Edson MA, Fitzgerald KA, Olech LJ, et al. Evaluation in vitro of adriamycin immunoconjugates synthesized using an acid-sensitive hydrazone linker. Cancer Res 1990; 50:6600-7.
11. Willner D, Trail PA, Hofstead SJ, King HD, Lasch SJ, Braslawsky GR, et al. (6-Maleimidocaproyl)hydrazone of doxorubicin-a new derivative for the preparation of immunoconjugates of doxorubicin. Bioconjug Chem 1993; 4:521-7 .
12. Siegel MM, Tabei K, Kunz A, Hollander IJ, Hamann RR, Bell DH, et al. Calicheamicin derivatives conjugated to monoclonal antibodies: determination of loading values and distributions by infrared and UV matrixassisted laser desorption/ionization mass spectrometry and electrospray ionization mass spectrometry. Anal Chem 1997; 69:2716-26.
13. Junutula JR, Flagella KM, Graham RA, Parsons KL, Ha E, Raab H, et al. Engineered thio-trastuzumab-DM1 conjugate with an improved therapeutic index to target human epidermal growth factor receptor 2-positive breast cancer. Clin Cancer Res 2010; 16:4769-78.
14. Wang L, Amphlett G, Blattler WA, Lambert JM, Zhang W. Structural characterization of the maytansinoid-monoclonal antibody immunoconjugate, huN901-DM1, by mass spectrometry. Protein Sci 2005; 14:2436-46.
15. Lazar AC, Wang L, Blattler WA, Amphlett G, Lambert JM, Zhang W. Analysis of the composition of immunoconjugates using size-exclusion chromatography coupled to mass spectrometry. Rapid Commun Mass Spectrom 2005; 19:1806-14.
16. Lazar AC, Krishnamurthy R. Evaluation of the effect of sample composition and sample load on the mass spectrometric analysis of immunoconjugates, TPY403, at the Proceedings of the 55th American Society for Mass Spectrometry Annual Conference on Mass Spectrometry and Allied Topics, Indianapolis, Indiana June 3-7, 2007.
17. Stephan JP, Chan P, Lee C, Nelson C, Elliott JM, Bechtel C, et al. Anti-CD22-MCC-DM1 and MC-MMAF conjugates: impact of assay format on pharmacokinetic parameters determination. Bioconjug Chem 2008; 19:1673-83.
18. Sosic Z, Houde D, Blum A, Carlage T, Lyubarskaya Y. Application of imaging capillary IEF for characterization and quantitative analysis of recombinant protein charge heterogeneity. Electrophoresis 2008; 29:4368-76.
19. Aditya Wakankar, Yan Chen et al.Analytical methods for physicochemical characterization of antibody drug conjugates.Mabs3:161-172.
20. Francisco JA, Cerveny CG, Meyer DL, Mixan BJ, Klussman K, Chace DF, et al. cAC10-vcMMAE, an anti-CD30-monomethyl auristatin E conjugate with potent and selective antitumor activity. Blood 2003; 102:1458-65.

